RT-qPCR 实验操作(四):结果分析
数据要求
反应结束后需要确认扩增曲线及熔解曲线,标准扩增曲线为 S 型,熔解曲线呈单峰;
Ct 值介于 20–30 之间时,定量分析最准确;Ct 值小于 10 时,需要将稀释模板后,重新进行实验;Ct 值介于 30–35 之间时,需要提高模板浓度,或者增大反应体系的体积,以提高扩增效率,保证结果分析的准确性;Ct 值大于 35 时,检测结果无法定量分析基因的表达量,但可用于定性分析。
定量实验至少需要三个生物学重复;所有复孔间的差别应该在 0.5 Ct 内;在 35 个循环以后,Ct 值变化较大,定量结果可能不太可靠。
标准扩增曲线为 S 型,如下图:
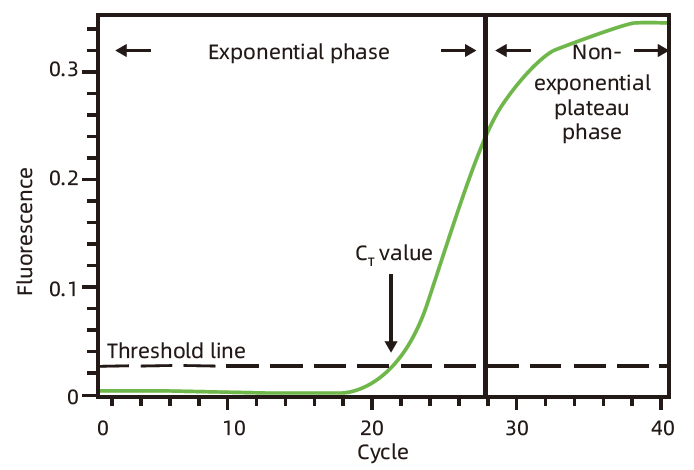
PCR 前期,目的 DNA 以指数形式扩增,这一扩增时期称为指数期(Exponential phase);PCR 后期,由于引物和 dNTP 等反应底物的减少,目的 DNA 片段扩增的速度变慢,直至停止,这一扩增时期称为平台期(Plateau phase)。qPCR 过程中,荧光值随着目的 DNA 的扩增而增加,当荧光值达到阈值时的循环数称为 Ct 值,Ct 值越小,说明目的 DNA 的初始浓度越大。
熔解曲线是 SYBR Green 法 qPCR 实验中评价扩增特异性的关键指标,只有熔解曲线呈单峰,才能说明 qPCR 是特异扩增。一般产物的熔解温度 Tm 值(熔解曲线的峰)在 75–90 °C,如果在较低温度有一个小峰,可能是引物二聚体;如果 Tm 值在 90 °C 以上,说明目的片段 GC 含量过高,或者扩增长度过长。另外,如果 cDNA 样本中有 gDNA 残余,且 gDNA 也发生扩增时,也会造成双峰。可以将 qPCR 产物进行凝胶电泳,和熔解曲线的结果相互印证。一般熔解曲线中有几个峰,电泳中泳道里就有几条带。
2-ΔΔCt 法计算目的基因相对表达量
假设计算目的基因(Target)在给药组(Treatment)中相对于模型组(Control)的表达量,其中内参基因(References)在总 RNA 中表达稳定。计算公式如下:
\[ \Delta Ct = Ct_{Target} - Ct_{Reference} \]
\[ \Delta\Delta Ct = \Delta Ct_{Treatment} - \Delta Ct_{Control} \]
\[ Relative\ Expression = 2^{-\Delta\Delta Ct} \]
内参基因(Reference gene),又称看家基因,这类基因在不同的样本中表达量比较稳定,如 β-actin、tubilin、16s rRNA、GAPDH 等。在相对定量中,内参基因可以校准不同样本间总 RNA 量的差异。
考虑到实际实验中,每组至少有三个生物学重复,因此各样品
\[ \Delta Ct = Ct_{Target} - Ct_{Reference} \] ,并计算各样品
\[ 2^{-\Delta Ct} \]
,其中
\[ \overline{2^{-\Delta Ct}_{Control}}=\frac{\sum{2^{-\Delta Ct}_{Control}}}{n} \]
,因此
\[ Relative\ Expression = 2^{-\Delta\Delta Ct}=\frac{2^{-\Delta Ct}}{\overline{2^{-\Delta Ct}_{Control}}} \]
,并对各样品的 RNA 相对表达量进行统计学比较。